LA MITOCONDRIA
Hace unos 1.500 millones de años, una célula procariota capaz de obtener energía de los nutrientes orgánicos empleando el oxígeno molecular como oxidante, se fusionó en un momento de la evolución con otra célula procariota, o eucariota primitiva, al ser fagocitada sin ser inmediatamente digerida; un fenómeno frecuentemente observado.
De esta manera se produjo una simbiosis permanente entre ambos tipos de seres: la procariota fagocitada proporcionaba energía, especialmente en forma de ATP y la célula hospedadora ofrecía un medio estable y rico en nutrientes a la otra. Este mutuo beneficio hizo que la célula invasora llegara a formar parte del organismo mayor, acabando por convertirse en parte de él.
El descubrimiento de la mitocondria podría decirse que es un hecho colectivo como ninguno. Prueba de ello está en el gran número de términos acuñados que se refieren al mismo orgánulo: blefaroplasto, condrioconto, condriómitos, condrioplastos, condriosomas, condriosferas, fila, gránulos fucsinofílicos, Korner, Fadenkörper, mitogel, cuerpos parabasales, vermículas, sarcosomas, cuerpos intersticiales, plasmosomas, plastocondrios, bioblastos. Cowdry y Lehninger intentaron en 1918 sistematizar y unificar todos los términos.
Hasta hace poco tiempo se consideraba que la principal función de la mitocondria estaba limitada a la producción de energía en forma de ATP. Sin embargo, parece que la mitocondria actúa también como el escenario integrador de una cadena de estímulos inductores para la apoptosis y desencadena una serie de cascadas de señalización que terminan con la muerte de la célula.
Las mitocondrias son organelos intracelulares presentes en prácticamente todas las células eucariotas. Están encargados de suministrar la mayor parte de la energía necesaria para la actividad celular, sintetizan ATP a expensas de glucosa, ácidos grasos y aminoácidos por medio de la fosforilación oxidativa.
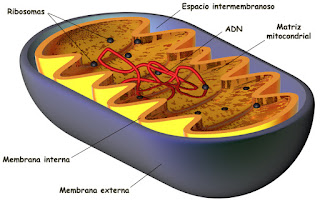
 La mitocondria tiene un tamaño variable entre 0.1μm y 0.5μm de diámetro y pueden alcanzar una longitud máxima de 7μm, sin embargo éste depende de la actividad de la célula. En promedio hay unas 2000 mitocondrias por célula, pero las que desarrollan mayor actividad metabólica, como las musculares, tienen un número mayor en comparación con las poco activas, por ejemplo las células epiteliales. Posee un sistema de doble membrana una externa y una interna, que separan tres espacios bien definidos: el citosol, el espacio intermembranal y la matriz mitocondrial.
La mitocondria tiene un tamaño variable entre 0.1μm y 0.5μm de diámetro y pueden alcanzar una longitud máxima de 7μm, sin embargo éste depende de la actividad de la célula. En promedio hay unas 2000 mitocondrias por célula, pero las que desarrollan mayor actividad metabólica, como las musculares, tienen un número mayor en comparación con las poco activas, por ejemplo las células epiteliales. Posee un sistema de doble membrana una externa y una interna, que separan tres espacios bien definidos: el citosol, el espacio intermembranal y la matriz mitocondrial.
En ciertos tipos celulares las mitocondrias pueden permanecer inmóviles en determinadas regiones del citoplasma, en respuesta a una importante demanda local de energía, pero en la mayoría de las células, las mitocondrias son muy móviles y utilizan al citoesqueleto y sus proteínas motrices asociadas para desplazarse.
Estos orgánulos tienen reproducción intracelular independiente y contienen su propio genoma, lo cual coadyuva a la complejidad de sus alteraciones, causadas por mutaciones en los genes nucleares o mitocondriales. Las mitocondrias se autoduplican y asi aumentan su número en la célula.
Las mitocondrias son destruidas y sus componentes son reciclados, gracias al fenómeno de AUTOFAGIA, en el compartimiento lisosomal. En un hepatocito, una mitocondria dura aproximadamente 10 días.
Las dos membranas de la mitocondria delimitan dos compartimientos, el espacio intermembranal o Cámara Externa y el espacio comprendido dentro de la membrana interna, denominado Cámara Interna.
Las dos membranas presentan zonas de fusión transitorias en las cuales se llevan a cabo intercambios entre el citosol y la mitocondria
Las dos membranas presentan zonas de fusión transitorias en las cuales se llevan a cabo intercambios entre el citosol y la mitocondria
La Membrana Interna es una bicapa lipídica que posee proteínas en mayor cantidad que la membrana plasmática. Varios tipos de complejos protéicos intervienen en el transporte de moléculas desde el citosol hacia los dos compartimientos mitocondriales. Son PERMEASAS no glicosiladas denominadas PORINAS (30.000 daltons) que forman poros acuosos que permiten el transporte masivo de moléculas de talla inferior a los 10.000 daltons.
Las PORINAS interactúan con proteínas motrices asociadas a los microtúbulos y esto parece ser la base molecular del transporte o movimiento de las mitocondrias por el citoplasma.
La Cámara Externa es un espacio muy estrecho para el tránsito de moléculas. Contiene protones H+ y una hemoproteína denominada Citocromo C, que circula entre las dos membranas.
La Membrana Interna tambien es una bicapa lipídica, más rica en proteínas que la membrana externa (> de 6.000 partículas/um2). Presenta numerosos pliegues o crestas mitocondriales. Posee, gracias a las crestas, una superficie que triplica en proporción a la de la membrana externa mitocondrial. La morfología de las crestas varía según el grado de actividad y el tipo celular (alargadas en los hepatocitos, tubulares en las células que secretan esteroides...).El número y la superficie de las crestas está en relación con la demanda de ATP por parte de la célula (son más numerosas en las mitocondrias de las células del miocardio que en un hepatocito).
La genética del ácido desoxirribonucleico mitocondrial (ADNmt) se diferencia de la del ADN nuclear en 4 aspectos fundamentales:
Las mitocondrias y, por tanto, el ADNmt , solo se transmiten a través del óvulo, cuyo citoplasma es mucho más grande que el del espermatozoide que no contribuye con mitocondrias en la fecundación. Numerosas anomalías congénitas o adquiridas del genoma mitocondrial son la causa de varias patologías humanas (ciertas enfermedades neuromusculares).
En cada célula hay cientos o miles de moléculas de ADNmt. Durante la división celular, las mitocondrias se distribuyen al azar entre las células hijas.
La tasa de mutación espontánea del ADNmt es 10 veces mayor que en el ADN nuclear.
El ADN ó DNA mitocondrial, que se halla empaquetado en una molécula circular de 16.569 pares de bases, ha sido completamente secuenciado y se conoce que contiene información para 37 genes: 2 tipos de ácido ribonucleico ribosomal (ARNr), 22 ARN de transferencia (ARNt) y 13 polipéptidos que son subunidades de enzimas de los complejos de la fosforilación.
La Mitocondria juega un papel central en diversas funciones celulares, como son: la producción de energía, la modulación del estado redox, el balance osmótico, la regulación y homeostasis de Ca2+ y la comunicación entre los organelos. Además, interviene en la respuesta celular ante múltiples y variadas situaciones de estrés fisiológico y genético, así como en complejos procesos, como la proliferación celular y la senescencia.
En las mitocondrias se desarrollan distintas reacciones bioquímicas catabólicas que liberan importantes cantidades de energía, la cual se almacena en forma de ATP y es usada para mantener la actividad celular. En los organismos aeróbicos más del 90% del ATP proviene de las mitocondrias, el resto se forma en la glicólisis anaeróbica. El ATP es una molécula relativamente simple, formada por una ribosa, una adenina y tres fosfatos. La unión entre los fosfatos se conoce como unión pirofosfato. Cuando el ATP se hidroliza a ADP y fosfato, se liberan aproximadamente 7.500 calorías por mol.
La energía que se obtiene a través de la transferencia de electrones a lo largo de la cadena transportadora es usada para bombear protones desde la matriz mitocondrial hacia el espacio intermembranal, creando un gradiente electroquímico de protones a través de la membrana mitocondrial interna (ΔΨm: potencial de membrana mitocondrial). Este gradiente de protones permite a la ATP sintasa utilizar el flujo de H+ generados para producir ATP a partir de adenosina difosfato (ADP) y fosfato inorgánico. De esta manera, la membrana mitocondrial interna separa dos compartimientos de diferente concentración de H+, lo que produce diferencias en la concentración química (ΔpH) y en la distribución de la carga (ΔΨm) a través de la membrana. El resultado neto es la fuerza protón motriz (ΔG).
 |
| En la fosforilación oxidativa, el flujo de electrones desde el NADH y el FADH2 hasta el oxígeno conduce al bombeo de H+ desde la matriz hacia el espacio intermembranoso. |
 |
| Este gradiente de H+ puede producir ATP cuando pasa a través de la ATP sintasa en la membrana mitocondrial interna. |
LA APOPTOSIS CELULAR
La apoptosis es un mecanismo regulador esencial que interviene en la homeostasis tisular y en el desarrollo normal, eliminando las células innecesarias.
La mayoría de estímulos que conducen a la apoptosis convergen en la mitocondria y provocan una permeabilización de su membrana externa. Con la permeabilización se liberan una serie de proteínas que activan las caspasas. Éstas inducen la mayoría de los acontecimientos proteolíticos de la apoptosis y son consideradas como responsables finales de la muerte celular. En el citoplasma y en el espacio intermembranal de las mitocondrias se localizan en forma de procaspasas, las cuales son activadas por clivaje y actúan como ejecutoras que escinden moléculas de supervivencia celular y ponen en marcha las actividades que inducen la muerte de la célula.
Durante décadas se consideró a la mitocondria como un organelo encargado exclusivamente de oxidar sustratos, produciendo agua en un proceso acoplado a la fosforilación en la producción de ATP. En la actualidad se sabe que en la mitocondria existe un proceso latente de transporte, conocido como “permeabilidad transicional mitocondrial”, cuya activación se presenta bajo ciertas condiciones y se traduce en la permeabilización de la membrana mitocondrial a iones que incluyen el calcio. Se ha propuesto que esta permeabilidad mitocondrial, podría ser una de las vías de conducción de moléculas pro-apoptóticas.
Hoy en día, se sabe que el poro se abre cuando hay un exceso de calcio y fosfato, lo que despolariza la mitocondria y desacopla la cadena respiratoria. El poro de permeabilidad transicional mitocondrial (PTPm), favorece la cascada de caspasas y favorece la muerte celular al liberar factores inductores de apoptosis como el citocromo c, factores de fragmentación del núcleo y proteínas como SMAC/DIABLO (Second Mitochondria-derived Activator of Caspases / Direct IAP-Binding protein with low pI).
Curiosamente, Smac/DIABLO, es una proteína mitocondrial normal, pero su liberación al citosol celular induce apoptosis, presumiblemente siguiendo las mismas ruta de salida que el citocromo c. Por tanto, si una célula está comprometida a sufrir apoptosis y libera el contenido mitocondrial al citosol, entonces Smac/DIABLO secuestra las proteínas IAPs y se asegura que estas proteínas no intenten parar el programa en curso.
Es ahora claro que la mitocondria juega un papel crítico en la muerte celular en la regulación tanto de la apoptosis como de la necrosis. La permeabilización de la membrana mitocondrial y liberación de proteínas al espacio intermembranal son características importantes de estos dos mecanismos.
 |
| La vía mitocondrial se ejecuta en respuesta a intromisiones externas y a daño en el DNA. |
La otra via de apoptosis es la conocida como extrinseca o de los recepctores de muerte.Los receptores de muerte de la familia del receptor de TNF (TNFR) incluyen TNFR1, Fas (CD95), DR3/WSL y los receptores del ligando inductor de apoptosis relacionado con el TNF (TNF-related apoptosis-inducing ligand, TRAIL)/Apo-2L (TRAIL-R1/DR4, TRAIL-R2/DR5). Los miembros de esta familia están caracterizados por presentar de dos a cinco copias de un dominio extracelular rico en cisteína. Los receptores de muerte también poseen un dominio intracelular en el C-terminal del receptor denominado dominio de muerte (death domain, DD ). Cuando un ligando se une a estos receptores se puede producir la muerte por apoptosis de la célula que los posee.
La vía de los receptores de muerte y la vía mitocondrial convergen a nivel de la activación de la caspasa-3. El solapamiento y la integración de las dos vías se debe a Bid, un miembro proapoptótico de la familia de Bcl-2. La caspasa-8 media la ruptura de Bid incrementando enormemente su actividad proapoptótica que resulta en su translocación a la mitocondria donde promueve la liberación del citocromo c. Hay que tener en cuenta que en la mayoría de las condiciones, este solapamiento es mínimo, y las dos vías operan de manera independiente.


.jpg)


.jpg)
.jpg)



No hay comentarios:
Publicar un comentario